본문영역
교모세포종(GBM) 치료
신호분석1
2019/05/18 07:55 (221.166.***.151)
댓글 3개 조회 1,192 추천 20 반대 0
Glioblastoma Multiforme : 임상적 제시와 치료를 통한 역학 및 병태 생리의 검토
Farina Hanif, Kanza Muzaffar, [...], Shabana U Simjee
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5563115/
추상
Glioblastoma multiforme (GBM)은 중추 신경계 종양 중 가장 악성 유형 중 하나입니다.
치료 양식의 발전에도 불구하고 여전히 치료가 불가능합니다.
우리의 검토 목적은 GBM 역학, 병인학, 병인, 임상 소견 및 치료에 대한 전체적인 그림을 제공하는 것입니다.
문맥 검색은 PubMed 및 Google Scholar의 GBM에 대해 다형성 교 모세포종 (glioblastoma multiforme), 병인 발생, 증상 및 징후와 같은 관련 키워드를 사용하여 수행되었으며 2015 년까지 발표 된 논문을 검토했습니다.
방사선 및 특정 유전 증후군이 GBM으로 현재까지 확인 된 유일한 위험 요인이라는 것이 밝혀졌다.
종양 부위에 따라 환자는 증상이 다양한 클리닉에 출석할 수 있습니다.
종양의 존재와 범위를 확인하기 위해 다양한 침습적 및 비침습적 이미징 기술이 필요합니다.
문헌 조사에 따르면 다중 유전적 변이와 변형 된 유전자 발현을 통한 다중 신호 경로의 이상을 포함하는 병인이 밝혀졌다.
수술과 보조 화학 요법, 방사선 요법과 같은 여러 가지 치료법을 사용할 수 있지만 이 질환은 예후가 좋지 않으며 환자는 일반적으로 진단 후 14 개월 이내에 사망합니다.
키워드 : 다형성 교 모세포종, 역학, MRI 스캔, 돌연변이, 테모 졸로 미드
소개
Glioblastoma Multiforme (GBM)
신경교종은 원발성 뇌종양을 설명하는 데 사용되는 일반적인 용어로, 추정 된 기원 세포에 따라 분류됩니다.
여기에는 성상세포종양 (성상세포종, 퇴행성 성상세포종 및 아교모세포종), 희소돌기아형종, 상행정선종 및 혼합신경교종이 포함됩니다. (네덜란드, 2000; Maher et al., 2001; Schwartzbaum et al., 2006; Agnihotri et al., 2013).
이들은 중추 신경계 (CNS)에서 가장 흔하게 발생하는 종양으로, 모든 악성 원발 종양의 약 80 %를 차지합니다 (Schwartzbaum 외, 2006; Agnihotri 외, 2013; Messali 외, 2014 ).
다형성 아교모세포종은 가장 악성이며 자주 발생하는 일차 성상 세포종입니다.
그것은 성인의 모든 뇌종양의 60 % 이상을 차지합니다 (Rock et al., 2014).
GBM에 대한 현대 요법의 다양성에도 불구하고, 그것은 여전히 매우 나쁜 예후를 가진 치명적인 질병입니다.
환자는 대개 진단 후 약 14-15 개월의 중간 생존율을 보입니다 (Ohka et al., 2012; Thakkar et al., 2014).
WHO 등급 분류
신경교종의 명명법 및 진단에 대한 현재 국제 표준은 WHO (World Health Organization) 분류입니다.
그것은 조직 병리학 적 기준에 의해 결정되는 악성 종양의 수준에 기초하여 신경 교종을 1 등급 내지 4 등급으로 분류한다.
Grade I gliomas는 증식 잠재력이 낮고 외과 수술로 치료할 수있는 병변과 관련이 있으며 II 급 ~ IV 신경교종은 매우 악성이며 침습적입니다.
다형성 아교모세포종은 가장 공격적이고 침습적이며 미분화 된 종양으로 WHO에 의해 4 등급으로 지정되었습니다 (Louis et al., 2007; Jovčevska et al., 2013).
역학
GBM은 전 세계적으로 10 만 명당 10 명 미만으로 드문 종양이지만 진단 후 14-15 개월의 생존율로 예후가 좋지 않은 공중 보건 문제 (Iacob & Dinca, 2009, Thakkar 외, 2014) .
참고)
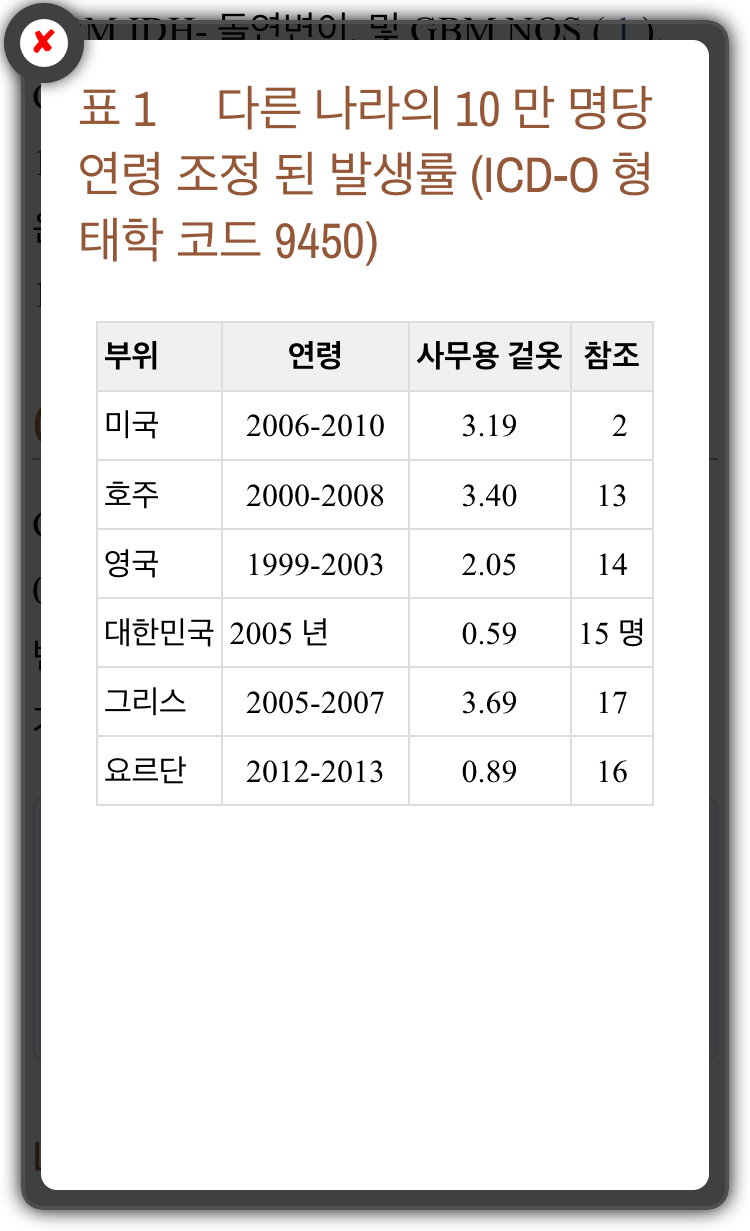
모든 연령층에서 모든 신경교종의 50 %를 차지합니다 (Rock et al., 2014).
모든 연령대에서 발생할 수 있지만 최대 발생률은 55 ~ 60 세입니다 (Ohgaki and Kleihues, 2005).
악성 신경교종은 암으로 인한 사망의 2.5 %의 원인이며 15 세에서 34 세 사이의 암으로 인한 사망 원인 중 세 번째로 큰 원인입니다 (Salcman, 1990).
GBM 발병률은 여성에 비해 남성에서 더 높다 (Ohgaki and Kleihues, 2005; Thakkar et al., 2014).
서방 세계는 신경아교종의 발병률이 높고 덜 발달 한 국가 (Thakkar et al., 2014), 이는 신경아교종 사례보고, 보건 의료 이용의 제한 및 진단 관행의 차이로 인한 것일 수있다 (Fisher et al., 2007; Ohgaki, 2009).
흑인이 덜 수그러 들며, GBM의 발생률은 아시아 인, 라틴계 백인, 백인 등 다른 민족 집단에서 더 높다는 연구 결과는 거의 없다 (Iacob and Dinca, 2009).
ㅡㅡㅡ 중 략 ㅡㅡㅡ
GBM 치료
여러 국제적인 노력에도 불구하고 GBM 치료는 여전히 임상 종양학에서 가장 어려운 과제입니다 (Mrugala, 2013).
지난 10 년 동안 매우 다양한 성공 사례를 통해 다양한 치료법을 조사했습니다.
GBM의 치료에서 주요 과제는 질병의 위치와 복잡하고 이질적인 생물학과 관련이있다 (Kesari, 2011).
수술 접근법, 방사선 요법 및 보조 화학 요법의 발전으로 GBM 환자의 생존과 삶의 질이 점진적으로 개선되었지만 예후는 여전히 우울합니다.
그러나 현재 성공적으로 치료할 수 있는 특정 암에서 볼 수 있는 것과 유사한 긍정적인 결과를 보기 위해서는 훨씬 더 중요한 속도가 필요합니다 (Ohka et al., 2012; Mrugala, 2013).
고급 신경교종 환자에 대한 현재의 치료 표준은 치료 관리 (즉, 항종양 요법)를 포함 할뿐만 아니라 환자에게 효과적인 지원 치료를 제공하는 것을 포함합니다.
효과적인 지원 치료는 대뇌 부종, 발작, 위장관 장애, 골다공증, 정맥 혈전 색전증,인지 장애 및 기분 장애 관리 (Norden and Wen, 2006)로 구성된 질병의 다양한 징후와 증상을 관리하는 것을 수반합니다.
신경학적 증상의 징후 완화는 코티코 스테로이드를 투여함으로써 발생하지만, 그 실질적인 부작용으로 인하여 발생합니다.
그것은 대개 치료 체제 초기에 점점 가늘어지고 있습니다. Dexamethasone은 일반적으로 낮은 미네랄 코르티코이드 활성 (Omuro and DeAngelis, 2013)으로 인해 이러한 환자에서 선호되는 코르티코 스테로이드입니다.
발작 환자의 경우, Levetiracetam은 독성 프로파일이 낮고 화학요법제와의 약물 상호 작용이 없기 때문에 종종 처방됩니다 (Omuro and DeAngelis, 2013).
특정 치료 관리에는 방사선 치료와 함께 보조요법 테모졸로미드 (TMZ) 요법 (Mrugala, 2013)과 함께 종양의 수술 / 외과 적 절제가 포함됩니다.
외과
수술은 표준 치료의 주요 구성 요소입니다 (Ohka et al., 2012).
종양의 유형에 따라 수술은 종양 부담의 감소, 발작 조절, 신경 결핍의 역전, 국소 치료제의 도입 및 삶의 질 향상을 포함하여 많은 것을 성취 할 수있다 (Newton et al., 2007).
외과적 절제의 범위는 관련된 두뇌 영역의 위치와 웅변에 달려 있습니다.
GBM은 수술로 완전히 치료할 수 없는 국소 침습성 종양이며 (Iacob and Dinca, 2009) 원래의 병변의 가장자리에서 2 ~ 3cm 이내의 경우의 약 80 %에서 재발이 발생합니다.
그러나 새로 진단된 환자의 경우 외과적 절제 범위가 예후 가치가 있지만 (Scott et al., 2011), 다시 말하자면 웅변의 피질과 같은 부위에있는 종양,
방사선 요법
외과 적 치료는 방사선 치료로 진행되어 남아있는 종양 세포를 죽일 수 있습니다.
고 등급 신경아교종을 가진 환자의 기대 수명을 향상시키는 것으로 밝혀졌으며 (Scott et al., 2011), 근접 방사선 치료와 stereotactic 방사선 수술은 재발 GBM에 효과적인 치료법으로 밝혀졌지만 새로 진단 된 GBM 치료에 막연한 역할을합니다.
총 절제술을 받은 환자의 하위 집단은 정위 방사선 치료를 받은 후 생존 이점을 얻을 수 있습니다.
반대로, 과분할 방사선 요법은 GBM의 생존 결과가 특정 환자 하위 집단에서 실제로 바람직하지 않을 수 있음을 보여 주었다 (Chang et al., 2007).
GBM의 침습성, 방사선 괴사,
강도 변조 방사선 요법과 붕소 신경 세포 포획 요법은 새로운 방사선 기반 치료 요법 중 일부이며, 최근에는 악성 신경 교종 환자에서 효능을 평가하기 위해 실시되고 있습니다.
이러한 치료법을 사용한 치료는 독성이 적고 정상 조직에 대한 노출이 적으며 결과는 뇌종양 환자에게 사용되는 기존의 방사선 요법보다 열등하지 않다는 것을 시사합니다 (Norden and Wen, 2006).
화학 요법
환자의 생존율을 향상시키기 위해 여러 화학 요법 제제가 GBM의 치료에서 효과가 있는지 테스트되었습니다 (Curado et al., 2007; Iacob and Dinca, 2009).
그 중 테모졸로마이드 또는 TMZ (methylating agent), carmustine 또는 BCNU (bis-chloroethylnitrosourea)와 lomustine (CCNU)과 같은 알킬화제는 GBM의 대다수에서 임상 적으로 유리한 점을 보여 주었다 (Curado et al., 2007; Iacob and Dinca, 2009).
BCNU와 CCNU는 가혹한 세포 독성을 띄며 이러한 약물로 치료하면 내성이 일찌감치 발전하여 결과가 더욱 제한되고 많은 부작용이 발생합니다 ( 표 1) (Friedman et al., 2000).
Temozolomide는 GBM 환자에게 유일한 표준 화학 요법이다 (Reardon and Wen, 2006). TMZ 치료의 높은 가격을 제공 할 수있는 국가에서 적어도 보조 치료제 또는 방사선 요법과 병용되는 TMZ의 경구 투여가 GBM 환자에게 표준이되고있다 (Reardon and Wen, 2006; Iacob and Dinca, 2009) al., 2007).
TMZ의 세포 독성을 담당하는 주요 메커니즘은 구아닌의 N7 및 O6 위치에서 DNA를 메틸화하여 DNA 미스 매치 수선 시스템이 메틸화 된 구아닌에 대한 상보적인 염기를 발견하여 DNA에서 긴 살균을 일으키게하는 결과이다
G2-M 경계에서 세포주기를 차단하고 세포 사멸을 유발한다 (Scott et al., 2011).
하나, 종양 세포에서 MGMT (Methyl Guanine Methyl Transferase) 활성이 높으면 테모졸로미드 반응이 좋지 않은 것으로 나타났다.
MGMT는 알킬화 화학 치료제 (Chang et al., 2007)로부터 종양 세포를 보호하는 중요한 DNA 복구 단백질이다.
TMZ는 환자의 생존율을 약간 증가 시키지만, 많은 부작용을 유발할 책임이있다 (Friedman et al., 2000; Dario and Tomei, 2006; Singhal et al., 2007; Sengupta et al., 2012). 2007; Sengupta et al., 2012). 2007; Sengupta et al., 2012).
1 번 테이블
뇌종양 치료에 사용되는 흔히 사용되는 화학 요법 제제의 용량 및 부작용
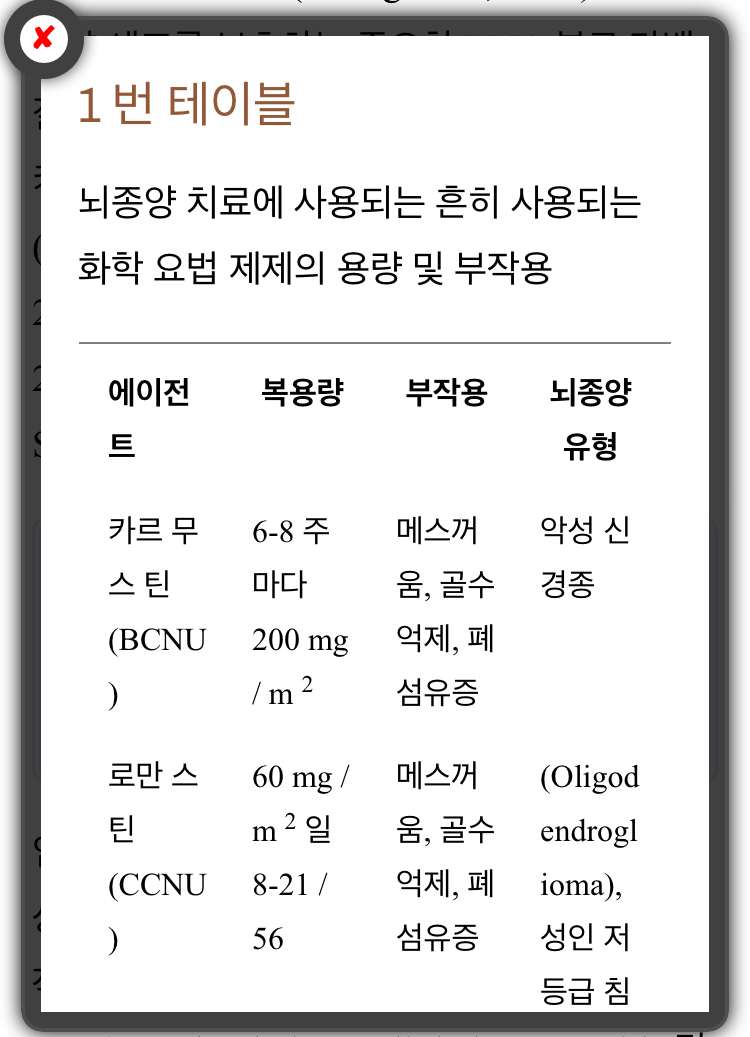

임상 실험에 따르면 BCNU 웨이퍼는 생존율에 상당한 이점을 보여 주 었으나 무시 무시한 부작용과 관련이 있습니다 (Iacob and Dinca, 2009).
Carboplatin, oxaliplatin, etoposide 및 irinotecan은 위에서 언급 한 약물에 반응하지 않는 환자의 두 번째 약물입니다. Procarbazine과 vincristine은 CCNU와 함께 TMZ가 우세한 첫 번째 약물이되었습니다.
GBM에 대한 다른 화학 치료법에는 항 -VEGF 단일 클론 항체 (베바 시주 맙), 항 -FGF 항체, EGFR (Erlotinib 및 Gefitinib) 및 티로신 키나아제 억제제 (Iacob 및 Dinca, 2009)를 겨냥한 단일 클론 항체가 포함됩니다.
이 평론은 GBM의 주요 측면을 논의하고 질병에 대한 포괄적인 지식을 제공합니다.
현재까지 GBM은 이질성 및 복잡한 병인성으로 인해 치료가 불가능합니다.
지속적인 연구 노력은 앞으로 질병 퇴치를 위한 더 나은 치료 옵션을 제공하는 데 도움이 될 것입니다.
저자 공개
ㅡㅡㅡㅡㅡㅡㅡㅡㅡㅡㅡㅡㅡㅡㅡ
성명서
저자들은 아시아 태평양 암 저널 (Cancer Prevention Journal)에서 정의한 경쟁적 이익이 없다고 선언했다.
ㅡㅡㅡㅡㅡㅡㅡㅡㅡㅡㅡㅡㅡㅡㅡ
신호분석1
님
관심회원수 0 쪽지보내기
작성자 최신글
작성자 최신글이 없습니다.
운영배심원 의견
신고
댓글 댓글접기 댓글펼침



